微信号
15618884964
炒股就看金麒麟分析师研报,权威,专业,及时,全面,助您挖掘潜力主题机会!
出品:新浪财经上市公司研究院
作者:天利
12月12日,百利天恒早间开盘20cm一字涨停,截至当日下午收盘,公司股价报131.11元/股创历史新高。消息面上,公司早间公告,全资子公司SystImmune和百时美施贵宝(BMS)日前宣布就SystImmune的BL-B01D1达成独家许可(金麒麟分析师)与合作协议。
合作协议生效后,BMS将向SystImmune支付8亿美元的首付款,达成开发、注册和销售里程碑后,SystImmune将获得最高可达71亿美元的额外付款,潜在总交易额最高可达84亿美元。然而,在对相关资料进行梳理后发现,百利天恒于该项交易中能够收获的实际利益难以衡量,公司对于全球研发费用是否需要分担的表述不够清晰,且或存在前后矛盾。
产品具备市场潜力
资料显示,BL-B01D1是一种基于双特异性拓扑异构酶抑制剂的ADC,可同时靶向作用于表皮生长因子受体和人表皮生长因子受体3(EGFR X HER3)。目前正在开展全球多中心I期临床研究(BL-B01D1-LUNG101),以评估其在转移性或不可切除的非小细胞肺癌(NSCLC)患者中的安全性和有效性。
此前,BL-B01D1的早期临床研究数据已在2023年的美国临床肿瘤学会年会(ASCO)、欧洲医学肿瘤学会年会(ESMO)以及圣安东尼奥乳腺癌研讨会(SABCS)上被公布。
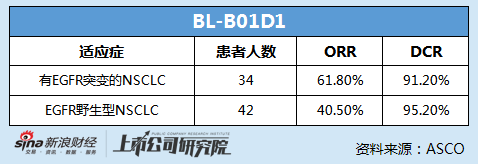
其中,BL-B01D1的FIH I期临床数据在2023ASCO上通过口头报告的方式呈现。临床数据显示,在34名有EGFR突变的NSCLC患者中,客观缓释率(ORR)达到61.8%,疾病控制率(DCR)达到91.2%;在42名EGFR野生型NSCLC患者中,ORR为40.5%,DCR为95.2%。
值得关注的是,入组的有EGFR突变的NSCLC患者此前均均接受过EGFR-TKI治疗,且88%的患者接受过3代EGFR-TKI治疗,68%的患者接受过含铂化疗。因此,BL-B01D1在治疗EGFR耐药的NSCLC方面具有较大潜力,且临床数据具备竞争力,同时安全性良好,未来或有希望突破EGFR-TKI耐药这一难题,弥补市场空白。
8亿美元首付款背后:全球研发费用如何分担?
然而,尽管BL-B01D1已显示出优秀的发展潜力,但目前仍仅读出Ⅰ期临床数据,尚未走出完成临床Ⅱ期的新药研发“死亡之谷”,产品未来的研发及商业化仍面临较大的不确定性。那么,BMS为何要为其豪掷8亿美元首付款?
需要指出的是,License-out许可协议包括了首付款及后续利润分配方案。由于潜在总交易额往往受限于管线对应适应症的市场规模以及利润分配方案,且与研发进展高度相关,存在较大不确定性,而首付款多为一次性支付且不可退回,因此首付款金额相对真实地反应了海外企业对于管线的价值评估。
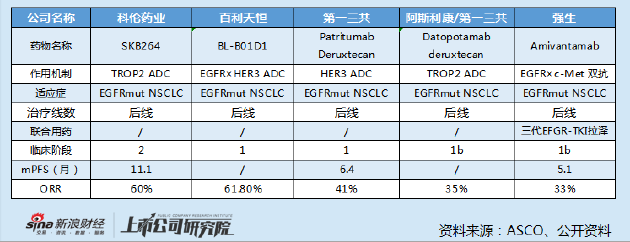
而从国内外ADC药物对外授权案例来看,如此高额的首付款十分罕见。以科伦博泰与默沙东的合作为例,科伦将其管线中七种不同在研临床前 ADC 候选药物项目以全球独占许可或独占许可选择权形式授予默沙东,里程碑付款合计93 亿美元,但首付款也仅有1.75 亿美元。
从适应症看,同样聚焦治疗EGFRmut NSCLC的TROP2 ADC SKB264,Ⅰ期临床结果显示客观缓释率并不输于百利天恒的BL-B01D1,但其授权给默沙东时的首付款也仅有4700 万美元。
唯一首付款高于BL-B01D1授权案例的为初代靶向HER2的ADC药物DS-8201,2019年03月28日,阿斯利康宣布第一三共达成协议,在全球范围内合作开发DS-8201,首付款13.5亿美元,里程碑金55.5亿美元,总金额达69亿美元。
彼时DS-8201治疗HER2低表达乳腺癌已进入关键性全球III期临床研究,并已于2019年1月完成首例患者给药。同时,第一三共在公告中已明确,双方将分别承担产品研发50%的研发费用,这或也是该项合作协议首付款较高的原因之一。
需要指出的是,在新药研发全流程中,临床试验阶段是研发费用支出的大头,且随着临床进度的推进研发费用逐步增多。其中:
I期临床试验:在少量(通常20到80人)健康志愿者或患者身上测试药物的安全性、耐受性、代谢和药效。这个阶段通常需要1到2年,花费约为800万-2.5亿美元。
II期临床试验:在较多(通常几十到几百人)患者身上测试药物的有效性、剂量和副作用。这个阶段通常需要2到3年,花费约为2000万-3.5亿美元。
III期临床试验:在更多(通常几百到几千人)患者身上与现有治疗方案进行比较,以证明药物的优势和安全性。这个阶段通常需要3到4年,花费约为3000万-5亿美元。
百利天恒2023年半年报显示,BL-B01D1目前正处于II期临床研究阶段,已累计投入研发费用约2.12亿元。可以预见的是,未来的研发投入还将进一步提升。同时,海外临床试验成本远高于国内,通常为国内的3倍以上,因此产品后续的研发费用如何分担尤为值得关注。
百利天恒公告显示,“根据合作协议,双方将合作推动BL-B01D1在美国的开发和商业化。SystImmune将通过其关联公司独家负责BL-B01D1在中国大陆的开发、商业化以及在中国大陆的生产,并负责生产部分供中国大陆以外地区使用的药品。BMS将独家负责BL-B01D1在全球其他地区的开发和商业化。”
同时,协议的主要内容部分存在如下表述,“SystImmune与BMS将分担BL-B01D1全球开发费用,以及在美国市场的利润和亏损。”
创新药管线所带来的亏损主要集中在研发费用,按照协议的主要内容部分表述,或可理解为公司将与BMS分担包括海外临床试验在内的研发费用,而公司同时又表示BMS将独家负责BL-B01D1在全球其他地区的开发和商业化,是否存在表述不清之嫌?公司能否明确相关研发费用如何划分?
微信号
15618884964